![]()
OBJETIVOS
INTRODUCCIÓN
La combustión constituye uno de los principales procesos, desde el punto de vista industrial, debido a la gran cantidad de energía que se libera y que puede ser utilizada para calefacción o para producir vapor de agua. Este vapor, entre otras posibilidades de utilización, puede emplearse para generar energía eléctrica mediante una turbina.
La reacción de combustión consiste, básicamente, en la oxidación de un combustible, normalmente un hidrocarburo, con oxígeno para dar CO2 y H2O. Si en la composición del combustible existe azufre también se formará SO2.
Los combustibles más habituales son: carbón, fuel-oil, gas natural y gases licuados del petróleo (fundamentalmente butano y propano). Por motivos económicos, el aire es la fuente de oxígeno que más se utiliza en los reactores de combustión. Se considera que el aire está formado por un 21% de oxígeno y un 79% de nitrógeno (porcentajes en volumen).
CONCEPTOS
Antes de abordar el estudio de los distintos sistemas en los que tienen lugar reacciones químicas, definiremos una serie de conceptos que aparecen en sistemas con reacción química. Todos ellos referidos a la unidad de tiempo elegida como base de cálculo, normalmente la hora o el segundo.
a) Reactivo limitante y reactivo en exceso: cuando los reactivos no entran en el sistema en cantidades o proporciones estequiométricas, lo que puede ser a veces conveniente, existirá un reactivo limitante. Este es el que según la estequiometría está en menor proporción y por tanto el resto estarán en exceso.
b) Conversión: generalmente, el reactivo limitante no reacciona en su totalidad (porque las reacciones alcancen un equilibrio o porque no haya tiempo material para que se complete la reacción), en este caso se dice que las reacciones son incompletas. Para expresar el grado de avance de la reacción se utiliza el concepto de conversión:
![]()
c) Aire teórico: la cantidad de aire u oxígeno necesario para la combustión completa. Se supone que el reactivo limitante es el combustible.
d) Exceso de aire: la cantidad de aire u oxígeno en exceso con respecto al requerido para la combustión completa. La proporción, en tanto por uno, de aire en exceso es idéntica a la de oxígeno y se calcula con la siguiente expresión:
![]()
e) Gases de combustión: gases que se producen durante la reacción de combustión y que abandonan el horno como efluente gaseoso. Se puede expresar su composición en base húmeda (fracciones molares de los componentes del gas de combustión considerando el agua) o en base seca (indica las fracciones molares del mismo gas sin considerar el agua).
f) Combustión completa: reacción que oxida todo el carbono a CO2 y todo el hidrógeno a H2O, sin que haya exceso de ningún reactivo (están en cantidades estequiométricas).
![]()
EJEMPLO
Sea un quemador al que se alimentan 100 kmol/h de heptano, que opera con una conversión del 80% y con un exceso de aire del 30%. Calcular:
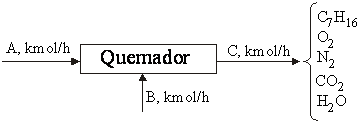
Sabiendo que A es la corriente de heptano puro (x=7, y= 16), B es la corriente de aire (79% N2 y 21% O2), y C es el efluente gaseoso que abandona el quemador (heptano no quemado, oxígeno, nitrógeno, dióxido de carbono y vapor de agua)
Resolución
En primer lugar se plantean los balances de materia a átomos o grupos de átomos que no se modifiquen por la reacción.
(1) Balance de materia al carbono (C): ![]()
(2) Balance de Materia al hidrógeno (H): ![]()
(3) Balance de materia al nitrógeno (N2): ![]()
(4) Balance de materia al oxígeno (O2): ![]()
(5) Conversión: ![]()
(6) Exceso de O2: 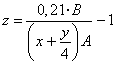
Las variables a considerar son: ![]()
Y las variables conocidas: X, z
Con lo que se obtiene un sistema de 6 ecuaciones con 7 incógnitas.
Para determinar el orden de resolución del sistema de ecuaciones y fijar la
base de
cálculo, preferiblemente una variable extensiva, se emplea el algoritmo de Lee,
Christensen y Rudd.
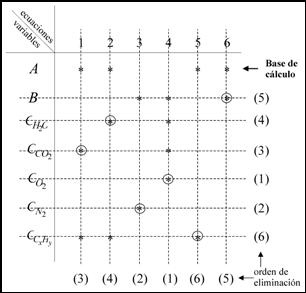
La secuencia de cálculo es la inversa a la de eliminación de ecuaciones y
cada variable
se determina con su ecuación correspondiente.
Fijando la alimentación (base de cálculo, A) en 100 kmol/h, la conversión (X) en
0,8 y
el exceso de aire (z) en 0,3 y aplicando los valores x = 7, y = 16 al sistema de
ecuaciones se obtiene:
ACTIVIDAD
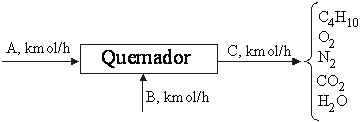
Supongamos que se quema butano con aire según la reacción, estequiométricamente ajustada, que se indica a continuación:
Calcule las corrientes de aire y gases de salida, así como la composición molar del
gas producido, para un caudal de alimentación
de 75 kmol/h, una conversión del butano de 85 % y un
exceso de aire del 25 %. Una vez realizados los cálculos oportunos comprueba los resultados con el
APPLET A : Caudal de alimentación en kmol/h
X : Conversión de butano
z : Exceso de aire REFERENCIAS FELDER, R.M. y ROUSSEAU, R.W.: Principios generales de los procesos químicos.
Ed. Limusa-Wiley, México (2003) HIMMELBLAU, D.M.: Principios y cálculos básicos de la Ingeniería Química. Ed.
Prentice-Hall: Pearson Educación, México (1997)
![]()
![]()
© Universidad de Jaén. Página
mantenida por María Inmaculada Romero.
Última actualización: 31 de marzo de 2005